

高等学校学習指導要領(平成30年度告示)解説 理科編 理数編1)の化学の章で示された熱化学の学習内容における歴史的な改訂が大きな話題を呼んでいる。これまで高等学校の化学において慣れ親しまれてきた熱化学方程式を取り扱うことが無くなり,代わりに,これまでは大学等で学習していた「エンタルピー」や「エントロピー」を高校生が学習することとなった。新しい化学の教科書2)においてもこの2つについて詳しい記述が掲載されている。加えて,発展としてギブズの自由エネルギー2)も掲載されており,この「熱化学」の単元は今回の高等学校化学の改訂において最も大きな変更点となった。
一方,現在の高校で教壇に立っている化学の教員の多くはエンタルピーやエントロピーを高校ではなく大学等で学習してきた。自分が大学等で学習した内容を高校生にどのように指導し,どう理解させていくのか,熱化学方程式と比較してその指導の経験もノウハウも乏しいと思われる。率直に申せば,若手,中堅,ベテランを問わず戸惑っている化学教員も少なくない。私もその一人である。
そこで,本校の生徒たちを対象に,エンタルピーやエントロピー,ギブズの自由エネルギーを学習する3時間の授業を構成し,実践した。その際,このエネルギーに関する新しい概念を生徒たちに体感させたい,直感的に理解させたいと考え,数種類の定番実験を取り入れた。その結果,生徒たちから大変興味深い反応が得られ,新課程の化学の授業展開のヒントとなるものが得られた。今回はその授業の構成や実践内容,および,授業を受けた生徒たちの感想等をご紹介したい。新課程の授業を控えていらっしゃる全国の化学の先生方に何か1つでもご参考になれば大変嬉しく思います。
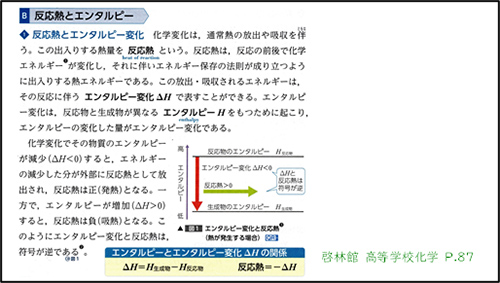
高等学校学習指導要領(平成30年度告示)解説 理科編 理数編1)第2章 第5節 3内容とその範囲,程度(2)物質の変化と平衡(ア)化学反応とエネルギー㋐化学反応と熱・光についてには,「化学エネルギーの差については,エンタルピー変化で表す。(中略)吸熱反応が自発的に進む要因に定性的に触れる際には,エントロピーが増大する方向に反応が進行することに触れることが考えられる。」と記載されている。これをうけ,今回改訂された教科書2)では,反応(変化)に伴い放出・吸収されるエネルギーを熱化学方程式では無くエンタルピー変化(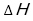 )で表している。また,反応(変化)が自発的に進む要因としてエントロピー変化(
)で表している。また,反応(変化)が自発的に進む要因としてエントロピー変化(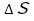 )を取り上げている。特に,エントロピー変化については定量的でなく定性的に,つまり,具体的な数値ではなく,増加したか(
)を取り上げている。特に,エントロピー変化については定量的でなく定性的に,つまり,具体的な数値ではなく,増加したか(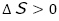 ),減少したか(
),減少したか(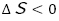 )に注目するという点は確認しておきたい。
)に注目するという点は確認しておきたい。

今回の授業は17名の3年生を対象に実施した。生徒たちは2年生の3学期に熱化学の単元で熱化学方程式,ヘスの法則,結合エネルギー等を学習している。
授業を行う前に,生徒にアンケート調査を行った。「化学反応の起こりやすさ(化学反応が起こる向き)には,どういう傾向があると思いますか?」と聞いたところ,下のような回答が寄せられた。物質量や温度,触媒,活性化エネルギー,イオン化傾向など,これまで化学の授業で学んできた内容に注目した回答が多かった。また,「反応前後のエネルギー変化が大きい」「反応熱が小さい」と回答した生徒もいたが,それは少数であった。回答した生徒たちと話をしていても,「化学反応が起こる向きなんて,あまり考えたことがない」という声が多かった。これが現行過程の化学で学んできた生徒たちの素直な感覚であると思われる。


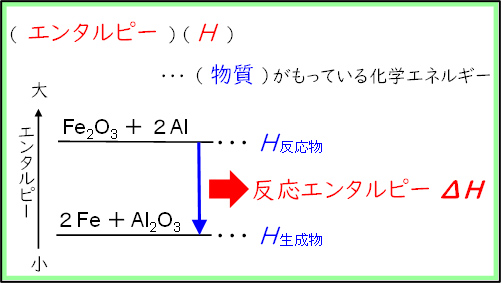
上記の通り,今回の授業を受けた生徒たちは2年生で熱化学を学習しており,その際はエンタルピーではなく熱化学方程式で表記していた。そこで,今回の実践では熱化学方程式での表記をエンタルピー表記に改めるところから始めることとした。具体的には,最初に生徒たちも扱いが慣れているエネルギー図を用いてエンタルピーの定義を紹介した後,熱化学方程式をエンタルピーで表記する練習を行った。
大学等で化学を学んだ我々教員からすると,エネルギー的に安定な方向,つまり,発熱反応は起こりやすく,逆に吸熱反応は起こりにくいことに違和感はない。しかし,化学を学び始めて間もない生徒たちにとってこの感覚は常識とは言いづらい。念のため,授業においても物質の燃焼等を例に挙げながら,この点を生徒たちと確認した。




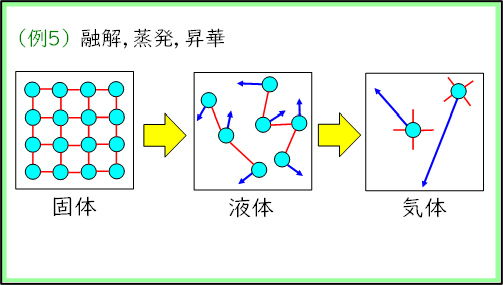
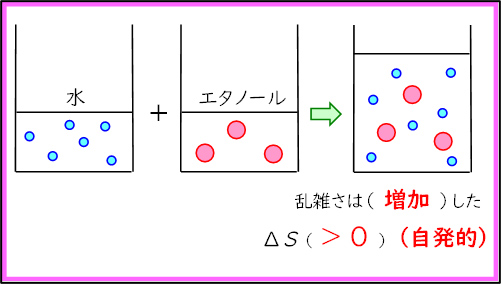
1時間目の授業の後半ではエントロピーについて学習した。「カレーのにおいは広がる」「水に入れたインクは拡散する」「部屋は散らかりやすい」といった生徒たちにとって身近な例を挙げながら「乱雑さ」の感覚をつかませた後,「気体の拡散」「浸透」「物質の混合」「物質の溶解」「融解・蒸発・昇華」「気体の発生・気体分子が増加する反応」といったエントロピーが増大する例を紹介していった。
生徒たちにエントロピーの感覚をつかませるための工夫として,次にエントロピーが減少する例として「凝縮・凝固」「気体の溶解」「沈殿の生成」「混合物の分離」「気体分子が現象する反応(ハーバー・ボッシュ法)」も取り上げた。
生徒たちにエントロピーの感覚をつかませるには,生徒たち自身が自発的に考えることが重要である。そこで,授業ではできるだけ発問を多くし,生徒たちの意見を取り入れながら展開するよう心がけた。

1時間目の最後ではまとめとして,エンタルピーが減少し(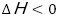 ),かつ,エントロピーが増加する(
),かつ,エントロピーが増加する(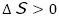 )場合の反応は自発的に進みやすく,その逆の場合は自発的には進みにくいことを確認した。また,エンタルピーは減少する(
)場合の反応は自発的に進みやすく,その逆の場合は自発的には進みにくいことを確認した。また,エンタルピーは減少する(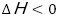 )がエントロピーが増加する(
)がエントロピーが増加する(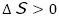 )場合や,エンタルピーは増加する(
)場合や,エンタルピーは増加する(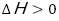 )がエントロピーが減少する(
)がエントロピーが減少する(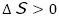 )場合については,次の時間に実験しながら考えていくことを予告して1時間目を終えた。
)場合については,次の時間に実験しながら考えていくことを予告して1時間目を終えた。

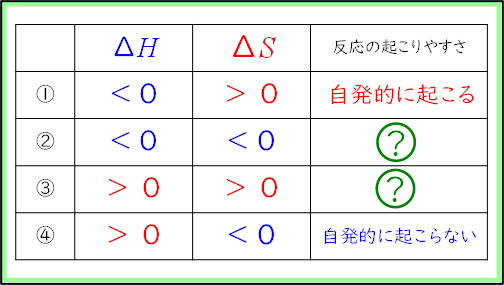
2時間目の授業では生徒たちにエンタルピーやエントロピーを直感的に理解させるため,中学校の理科や高校の化学でよく行われている定番の実験を3種類行った。その後,化学反応が自発的に起こる方向を考える指標としてギブズの自由エネルギーの式を導入した。
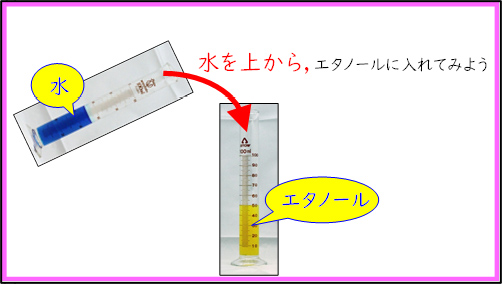
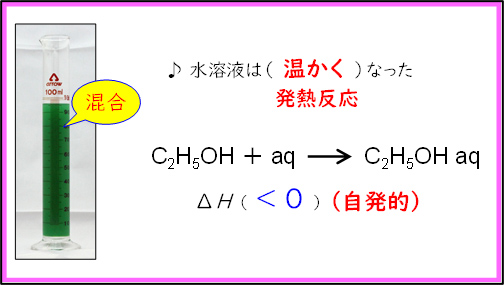
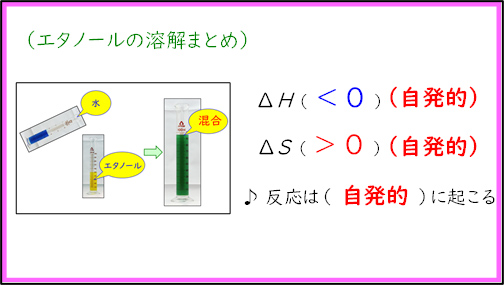
最初の実験は「水とアルコールの混合」を行った。黄色に着色したエタノールの上から,青く着色した水を加えると,溶液の色が緑となる。このとき,溶液の温度が上がるため,発熱反応(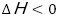 )であることが確認できる。また,純物質を混合したのでエンタルピーは増加している(
)であることが確認できる。また,純物質を混合したのでエンタルピーは増加している(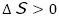 )。この場合,エンタルピー変化もエントロピー変化も化学反応が自発的に起こる方向であるため,水とアルコールの混合は起こりやすいことを確認した。
)。この場合,エンタルピー変化もエントロピー変化も化学反応が自発的に起こる方向であるため,水とアルコールの混合は起こりやすいことを確認した。
2番目の実験は,吸熱反応の定番である水酸化バリウムと硝酸アンモニウムの混合を行った。このとき,水で濡らした木の台の上にビーカーを置いて混合すると,ビーカーの周りが冷たくなる(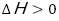 )だけで無く,ビーカーと木の台の間の水が凍ることが確認できる。うまくいけばビーカーと木の台がひっつき,ビーカーを持ち上げると,一緒に木の台も持ち上がる。このとき,アンモニア臭がすることから気体の発生,つまり,エントロピーの増加(
)だけで無く,ビーカーと木の台の間の水が凍ることが確認できる。うまくいけばビーカーと木の台がひっつき,ビーカーを持ち上げると,一緒に木の台も持ち上がる。このとき,アンモニア臭がすることから気体の発生,つまり,エントロピーの増加(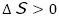 )が確認できる。以上より,エンタルピー変化は自発的な方向ではないが,エントロピー変化は自発的な方向であり,この反応が実際に起こることから,エンタルピー変化よりエントロピー変化の方が影響が大きいと考察した。
)が確認できる。以上より,エンタルピー変化は自発的な方向ではないが,エントロピー変化は自発的な方向であり,この反応が実際に起こることから,エンタルピー変化よりエントロピー変化の方が影響が大きいと考察した。
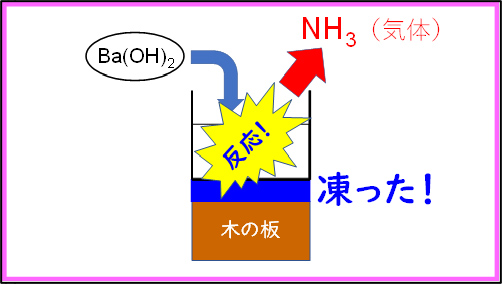



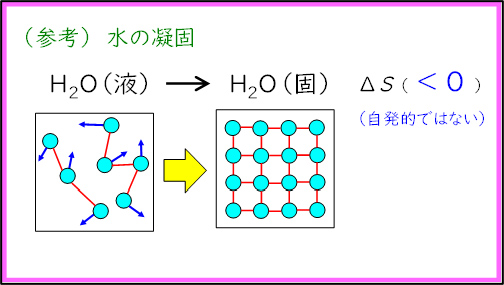
前述の通り,この反応によってビーカーと木の台の間にある水が凝固し,氷が生成する。この変化は発熱反応(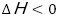 )であり,また,液体が固体に変化するためエントロピーは減少している(
)であり,また,液体が固体に変化するためエントロピーは減少している(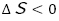 )。ビーカーの中で起こった反応とは異なり,水の凝固は常温では自発的には起こらないため,エンタルピー変化の影響の方がエントロピー変化より大きいと考察した。
)。ビーカーの中で起こった反応とは異なり,水の凝固は常温では自発的には起こらないため,エンタルピー変化の影響の方がエントロピー変化より大きいと考察した。


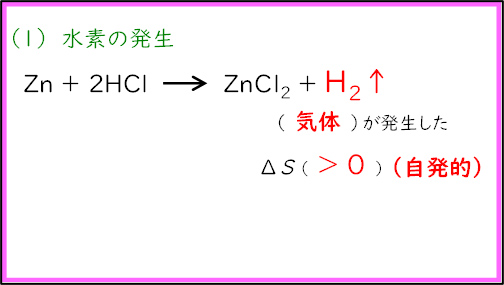
最後(3番目)の実験は中学校理科の定番である水素の発生を行った。塩酸に亜鉛板を入れ,発生した水素を水上置換法で捕集した。その後,捕集した水素に火を付け,ポン!と音が鳴ることを確認した。この反応では反応により塩酸の温度が上がることが確認できる(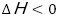 )。また,気体(水素)が発生しており,エントロピーは増加している(
)。また,気体(水素)が発生しており,エントロピーは増加している(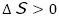 )。どちらも反応が自発的に起こる方向であり,この反応は起こりやすいと考察した。
)。どちらも反応が自発的に起こる方向であり,この反応は起こりやすいと考察した。


続けて,試験管に捕集した水素の燃焼についても考察を行った。水素に火を付けると音が鳴るのは空気の膨張によるものであり,これは水素の燃焼により熱が発生したことが原因である(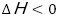 )。一方,水素と酸素は共に気体であり,反応によって気体分子の数が減少している,エントロピーも減少している(
)。一方,水素と酸素は共に気体であり,反応によって気体分子の数が減少している,エントロピーも減少している(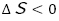 )。エンタルピー変化は自発的な方向,エントロピー変化は自発的な方向ではないが,この反応も実際に起こることから,エントロピー変化よりエンタルピー変化の方が影響が大きいと考察した。
)。エンタルピー変化は自発的な方向,エントロピー変化は自発的な方向ではないが,この反応も実際に起こることから,エントロピー変化よりエンタルピー変化の方が影響が大きいと考察した。
3回目の実験とその考察であったため,生徒たちも化学反応をエンタルピーとエントロピーの視点で考察することに慣れてきて,教師からの発問にも特に悩む様子も無く回答していた。今回の3種類の実験により,生徒たちがエンタルピーとエントロピーを直感的に理解している様子がうかがえた。
このように,エンタルピーもエントロピーも増加する場合や(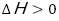 ,
,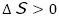 ),エンタルピーもエントロピーも現象する場合は(
),エンタルピーもエントロピーも現象する場合は(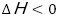 ,
,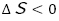 ),化学反応が自発的に進む方向はこの2の要素の兼ね合いで決まることを生徒たちと確認した。この点についても,生徒たちは特に違和感なく受け入れていた様子であった。
),化学反応が自発的に進む方向はこの2の要素の兼ね合いで決まることを生徒たちと確認した。この点についても,生徒たちは特に違和感なく受け入れていた様子であった。



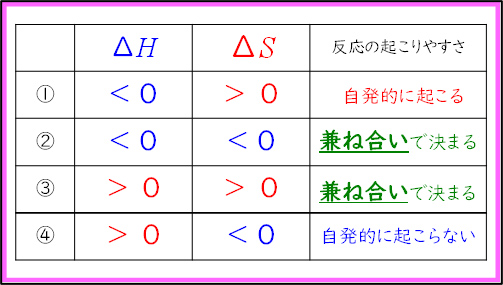
この授業の最後には,エンタルピー変化とエントロピー変化を同時に表したものとして,ギブズの自由エネルギーの式を紹介した。生徒たちは2つの要素を1つの式で表せることに驚いていたが,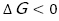 となる方向に化学が進むことには納得した様子であった。
となる方向に化学が進むことには納得した様子であった。


3時間目の最初には,前時の復習を兼ねてゴムを使った簡単な実験を行った。最初にバルーンアート用の細長い風船(ペンシルバルーン)を1人1個ずつ配布し,膨らませる前のそのままの状態で鼻の下もしくは頬に当て,その温度を確認した。次に,風船を左右に長く引っ張った状態で同様に温度を確認した。このとき,風船が温かくなっていることが確認できる。
力を抜いて風船を元の大きさに戻すと,風船は元の温度に戻る( )。このとき,引き延ばした状態から元の状態に戻るため,エントロピーは増加している(
)。このとき,引き延ばした状態から元の状態に戻るため,エントロピーは増加している( )。エンタルピーやエントロピーを生徒たちにとって身近な風船で確認できることは,前時までの復習になったと同時に,生徒たちの直感的な理解の助けになっていたようであった。
)。エンタルピーやエントロピーを生徒たちにとって身近な風船で確認できることは,前時までの復習になったと同時に,生徒たちの直感的な理解の助けになっていたようであった。
エンタルピー,エントロピー,ギブズの自由エネルギーは,学習指導要領の改訂を待たず,2022年の私立大学入試に出題されている。芝浦工業大学では問題文中にギブズの自由エネルギーの式を示し,その式を使って考える問題が出題された。関西学院大学ではギブズの自由エネルギーをハーバー・ボッシュ法に当てはめて考える問題が出題された。授業ではこの2問を取り上げ,生徒たちと共に考えた後に解説を行った。
今後の大学入試においてもエンタルピーやエントロピーは少なからず出題されると予想される。また,ギブズの自由エネルギーの出題も十分に考えられる。今回の授業でも一抹の不安を覚えながら生徒たちが取り組む様子を観察していたが,前時に生徒たちが直感的に理解できる実験を行った経験は大きかったようで,苦手意識をもった様子も無く生徒たちは率先して,楽しそうに取り組んでいた。今回の3種類(風船まで入れれば4種類)の実験は生徒たちのエンタルピー,エントロピー,ギブズの自由エネルギーの理解を助けただけでなく,学びに向かう姿勢の向上にもつながっていたと思われる。
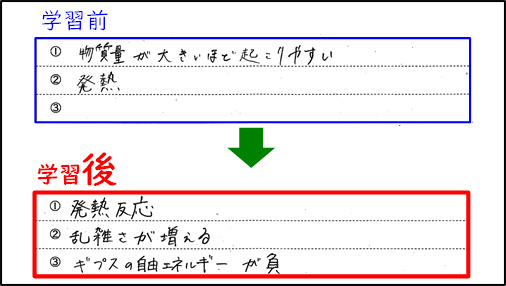
3時間の授業が終わった後,生徒たちに授業前と同様に「化学反応の起こりやすさ(化学反応が起こる向き)には,どういう傾向があると思いますか?(回答欄は3カ所)」と質問した。授業前に「①物質量,②発熱,③(未記入)」と答えていた生徒が授業後は「①発熱反応,②乱雑さが増える,③ギブズの自由エネルギーが負」と答えており,他の生徒たちにも同様の傾向が見られた。3時間の授業を通して生徒たちが化学反応が起こる向きをエンタルピーやエントロピー,ギブズの自由エネルギーで判断できることを学習した形跡が読み取れた。

授業を受けた生徒たちにその感想を聞いたところ,ある生徒は「化学反応式を見ると,たまに何故こっちの方向に反応が起こるのだろう? 逆には起きないのか? と疑問に思っていたので,スッキリしました。」と回答した。また,別の生徒は「今まで習っていた発熱反応や吸熱反応とは表し方や符号が逆なので,最初はどっちかわからなくなることがあった。」と回答したものの,続けて「エントロピーやエンタルピーの値を用いて式を作ったギブズの自由エネルギーはすごい式だと思った。」と記入していた。他にも「エンタルピーはわかるが,エントロピーという「乱雑さ」という定義しにくいものを数学的に処理したのがすごいと思った。」,「最初は少し理解にてこずったが,理解するとおもしろいと感じることができました。」,「吸熱反応やゴムの収縮による温度変化などの実験を通して,化学を楽しく学ぶことが出来たと思います。」といった意見が多かった。
授業前は私も「エンタルピーとエントロピーの学習は高校生にとってハードルが高いかな」と二の足を踏んでいたが,むしろ学習することで生徒たちの化学に対する理解を深めることもできることが示唆された。また,エンタルピーやエントロピーを学習したのなら,さらにギブズの自由エネルギーまで学習したほうが生徒にとって学習内容が体系化される可能性も示唆された。最後に,授業後のアンケートからエンタルピーやエントロピーの学習においても,実験を行いながら探究的に学習を進めることが生徒の理解を深めていくことも読み取れた。
今回の3時間の授業では,現行過程の生徒たちを対象としたため,熱化学方程式からのつながりを意識した。エンタルピー表記になると符号が逆になるなど生徒たちが混乱しそうな点もあったが,一度理解してしまえばそう大きな壁にはならないようであった。
次に,エンタルピーやエントロピーと関連して,ギブズの自由エネルギーの学習まで行った。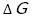 が正になるか負になるかという簡単なところまであったが,むしろここまで学習した方が生徒たちは納得感が得られることが示唆された。
が正になるか負になるかという簡単なところまであったが,むしろここまで学習した方が生徒たちは納得感が得られることが示唆された。
最後に,エンタルピーやエントロピーに関連する実験を複数用意し,それを行いながら生徒たちへの発問を多くしながら探究的に学習を進めた。中学校の理科や高校の化学では定番の実験ばかりであったが,エンタルピーやエントロピーという新しい視点で考えることは生徒たちに新鮮に映っていたようだ。加えて,生徒たちからは直感的に理解できた様子もうかがえたため,この単元でも実験を行いながら学習することは有効であると思われる。
今回の学習指導要領改定の歴史的な変更点であるエンタルピーやエントロピーの導入について,どう指導していけば良いのか悩まれている先生方は少なくない。今回の実践が何か1つでもご参考になれば望外の喜びです。