

新教育課程になって3年,そしていよいよセンター試験が最後の年となり,全国の理科の先生方もこの間,約3割増えた試験範囲をこなした上に,センター対策をするまでかなり大変であったと推察いたします。また来年度からの大学共通テストに向け,対策を練る必要があり,普段でも多忙である上に,今後に向けてさらなる多忙や困難が予想されます。
さて本校は普通科6(現3年のみ7)クラス,国際教養科1クラス規模の学校で,1年で化学基礎を全員,2年で3クラス,3年で4クラス理系選択者に化学を履修し,今担当している3年理系化学では,例年,無機化学から有機化学全般を11月中旬までに終わらせ,12月よりセンター対策を時間割および講座を再編成して実施しています。また現在本校は65分授業で,実験の内容を多くすることが可能ではあります。しかし化学はできるだけ実験に生徒自ら手を触れさせ,観察させてあげたいと日頃から考えていますが,範囲を終わらせることと相反し,実験を多くできないのが化学教師としての悩みです。
今回紹介する実験は,無機化学の範囲をできるだけまとめて,教科書または図説の色と見比べながら,金属イオンの沈殿や溶液の色を観察し,知識として定着できるよう企画しました。無機化学といったら「化学反応式」と「化合物の色」を覚えようと授業で強調していますが,色々な金属の種類や色に戸惑い,なかなか知識として定着していない現実があります。今回はクロム酸イオン(CrO42-)の変化,鉄(Ⅱ)イオン,鉄(Ⅲ)イオン,銅(Ⅱ)イオン,銀(Ⅰ)イオンの沈殿あるいは溶液の色の変化を生徒自らの目で見て観察することで,印象付けた上に,知識として定着できることを目的としました。
実験器具と使用薬品
薬品
| クロム酸カリウム(K2CrO4) | 硫酸鉄(Ⅱ) (FeSO4) | 塩化鉄(Ⅲ) (FeCl3) |
| 硫酸銅(CuSO4) | 硝酸銀(AgNO3) | 塩化カリウム(KCl) |
| 臭化カリウム(KBr) | ヨウ化カリウム(KI) | アンモニア水(NH3aq) |
| 水酸化ナトリウム水溶液(NaOHaq) | 塩酸(HClaq) | ヘキサシアニド鉄(Ⅱ)酸カリウム(K4[Fe(CN)6]) |
| ヘキサシアニド鉄(Ⅲ)酸カリウム(K3[Fe(CN)6]) | ||
実験①②の結果
| 酸 | ||
| クロム酸イオン(CrO42-) | → ← |
二クロム酸イオン(Cr2O72-) |
| 塩基 | ||

|

|
|
| 黄色水溶液 | 赤橙色水溶液 |
この実験のポイント
クロム酸イオン(CrO42-)の黄色が酸を加えることで二クロム酸イオン(Cr2O72-)の赤橙色に変わり,塩基を加えると黄色に戻ることを確認させる。
最も強い酸化剤として,硫酸酸性過マンガン酸カリウム,硫酸酸性二クロム酸カリウムを覚えさせ,酸性で赤橙色の二クロム酸カリウムになることを定着させる。また今回はできなかったが,クロム酸イオン(CrO42-)と銀イオン(Ag+),鉛イオン(Ⅱ)(Pb2+)およびバリウムイオン(Ba2+)と沈殿を生成し,それぞれAg2CrO4は赤褐色沈殿,PbCrO4およびBaCrO4はいずれも黄色沈殿になることも触れておきたい。また二クロム酸イオンの赤橙色とクロム酸銀の赤褐色に注意したい。
| ③の変化( 淡緑色→濃青色 ) | ④の変化( 黄褐色→濃青色 ) |
| ターンブルブルー | ベルリンブルー 紺青(こんじょう) |
実験②の結果
硫酸鉄(Ⅱ) → 水酸化鉄(Ⅱ)

淡緑色水溶液

緑白色沈殿
塩化鉄(Ⅲ) → 水酸化鉄(Ⅲ)

黄褐色水溶液

赤褐色沈殿
実験③④の結果
鉄(Ⅱ)+鉄(Ⅲ)錯イオン
鉄(Ⅲ)+鉄(Ⅱ)錯イオン
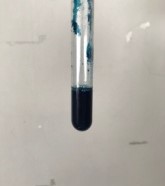
濃青色沈殿
実験にはない同じ価数の鉄と錯イオンの結果
鉄(Ⅱ)
+鉄(Ⅱ)錯イオン

青白色沈殿
鉄(Ⅲ)
+鉄(Ⅲ)錯イオン

暗褐色水溶液
この実験のポイント
鉄の色の変化が最も多く,生徒にとって覚えるのが大変である。また鉄(Ⅱ)は不安定で酸化して,鉄(Ⅲ)になり易いので,実験前に水溶液を調整することが必要である。水酸化物は鉄(Ⅱ)で淡緑色→緑白色,鉄(Ⅲ)では黄褐色→赤褐色(授業では信号の色で覚えようと指導している。黄色が赤色になり暗くなる(黄褐色→赤褐色→暗褐色水溶液(鉄(Ⅲ)と鉄(Ⅲ)の錯イオンの混合)),このように鉄(Ⅱ)に鉄(Ⅲ)の錯イオンまたは鉄(Ⅲ)と鉄(Ⅱ)の錯イオンは濃青色の沈殿ができることで有名であるが,あまり取り上げられていない鉄(Ⅱ)に鉄(Ⅱ)の錯イオンの混合で青白色の沈殿または鉄(Ⅲ)と鉄(Ⅲ)の錯イオンの混合では前述の暗褐色水溶液になることも確認したい。また今回できなかったが,チオシアン酸カリウム(KSCN)水溶液でFe(Ⅱ)イオンは変化しないが,Fe(Ⅲ)イオンは血赤色の水溶液が瞬時にできるので観察させたい。実験①②のCu2+イオンの結果
Cu2+イオン

青色水溶液
NH3aq
Cu(OH)2

青白色沈殿
NH3aq過剰
[Cu(NH3)4]2+

深青色水溶液
実験①②のAg+イオンの結果
Ag+イオン

無色透明水溶液
NH3aq
Ag2O

褐色沈殿
NH3aq過剰
[Ag(NH3)2]+

無色透明水溶液
この実験のポイント
銅,亜鉛はアンモニアを4配位,銀は2配位であることを確認させ,テトラアンミン銅(Ⅱ)イオンは正方形配位(ちなみに亜鉛は正四面体配位)で深青色のきれいな溶液になる。ジアンミン銀(Ⅰ)イオンは無色透明になることを確認させたい。またはじめは塩基により沈殿し,銅の色は鉄(Ⅱ)同様水酸化物の白色沈殿が加わることで,青色→青白色に変化する。さらに他の金属イオンは水酸化物になるが,銀はいったん水酸化物(AgOH)になるようだが,不安定ですぐに酸化銀(Ag2O)の褐色沈殿になることも確認させたい。この実験ではもこもこした褐色沈殿がスーと消えて無色透明の銀の錯イオンに変わるところが注目である。またこの水溶液は銀鏡反応に用い,アルデヒドを加えると銀鏡ができることも伝えておきたい。
実験①の結果
AgNO3aq

無色透明水溶液
AgCl

白色沈殿
AgBr

淡黄色沈殿
AgI

黄色沈殿
この実験のポイント
難溶性のハロゲン化銀の沈殿の色を覚えさせたい。「今回実験してないけどフッ化銀の沈殿って何色?」「ハロゲン化水素はすべて強酸?」と生徒に聞くと,しばらく考えて黙り込んでしまう。フッ化銀だけは水溶性で沈殿しないこと。(電気陰性度の差が大きいためイオン結合性が強い。)フッ化水素酸だけはガラス(SiO2)は溶かすけど,弱酸であることをしっかり定着させたい。有名なAgClの白色沈殿に対し,徐々に黄色が強くなっていく沈殿になることを定着させたい。
また光をあてると,銀が析出するが,銀色ではなく,黒っぽい沈殿になり,下にたまってくる。銀の指輪を付けたまま,硫黄の温泉に入ると,硫化銀になり,表面が黒くなることも,生徒に話しておきたい。
「実際に手にとって,薬品を混合し目で見ることで化学反応が実感できた。」「色の変化の過程を見ることができてよかった。」「酸化銀の褐色沈殿が透明に変わって行く瞬間に感動した。」など,予想通り,色の変化を伴う実験に対しては非常によい反応を示してくれた。それに伴って,知識の定着もできればよいのだが,テストになると,あれだけ説明し,自分の手でやったにもかかわらず忘れてしまっている生徒が多く残念である。様々な色があるので,系統別にしっかりまとめて整理し,知識として定着しておくことが重要である。
今回は,金属イオンの溶液と沈殿について,一度に順番に確認しながら,実施しました。どうしても様々な色が出てくることが,生徒にはわかりにくく,一部の生徒は何を混合しているのか理解できない者さえいる。ただ,化学実験の面白さは何といっても[色の変化]が大きな魅力である。色の変化とともに,どんな化学物質ができたのかを考える力が育成できたら,実験も目的達成ともいえる。いよいよ理科でも課題研究の検討,センター試験から大学共通テストへの移行など,より実験を実際にしていることで,解答できる問題などが出題されると予想されています。それにより益々理科の教員負担増の危惧があります。共通テストに向けて,より実践的で有用な実験内容の細部の検討などが必要不可欠になると考えられます。益々多忙になっている教育現場ですが,同じ理科を指導する教員仲間として,ともに研修しあい,学び会うことがこれからはさらに重要になると考えられます。高大連携を踏まえ,大学の先生も交えた研修会へ参加し,多くの仲間と討論しあい,教えあえるような場所と時間の確保が益々大切になってくるものと思われます。近年,社会的にもようやく認知されはじめてきた教員の長時間労働に対して,やっと始まった働き方改革が教員の働く時間の軽減や研修の充実および拡大につながっていくことを願っています。