
| (1) | 次の内容を熱化学方程式で表せ。
|
1 2 3 4 | ||||||||||
| (2) | メタンの燃焼熱を表す熱化学方程式は次の通りである。 CH4(気)+2O2(気)=CO2(気)+2H2O(液)+891kJ 4.0gのメタンが燃焼したときの発熱量を求めよ。 原子量H=1.0 C=12 |
|||||||||||
| (3) | 次の各化合物の生成熱を表す熱化学方程式を書け。( )は生成熱 [kJ/mol]を表す。
|
1 2 3 4 5 | ||||||||||
| (4) | 硫酸の溶解熱は95.3kJ/molである。硫酸49gを多量の水に溶かしたときの発熱量は何kJか。式量H2SO4=98 |
|||||||||||
| (5) | 物質が変化するとき発生または吸収する( 1 )は,変化の初めの( 2 )と最後の( 3 )により決まり,変化の( 4 )や方法には( 5 )である。これを( 6 )の法則という。 |
1 2 3 4 5 6 | ||||||||||
| (6) | 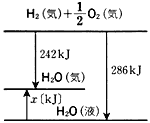 右のエネルギー図から,1molの液体の水が気体の水になるとき,( 1 )kJの熱を( 2 )することがわかる。この熱は( 3 )とよばれる。 右のエネルギー図から,1molの液体の水が気体の水になるとき,( 1 )kJの熱を( 2 )することがわかる。この熱は( 3 )とよばれる。 |
1 2 3 |
| 第2部 第7章へ 化学I 基礎理解 もくじ |