| 科学の歩みところどころ |
|
| 第25回 電気分解とイオン |
|
| 森 一夫 児島昌雄 |
|
| 今日,電気のない生活は想像もできないくらい,私たちは電気文明に浸りきっている。この電気文明も,その源をたどれば,今から180年前に発明されたボルタの電池に端を発しているといってもよいだろう。というのも,この電池によって初めて,人々は連続して流れる電気を得ることができたからである。ただそのしくみは,柱状に重ねた銀板と亜鉛板の間に,塩水でぬらした厚紙をはさんだだけの簡単なものであった。今回は,この電池を使って見つけ出された電気分解の現象に的をあて,その機構が明らかにされていった跡をたずねてゆこう。 |
|
|
電気分解の発見
|
|
| ボルタの電池をイギリスで初めて組み立てたニコルソンとカーライルは,針金と金属板との電気的接触を良くするため接触点に水をたらしたとき,針金の周囲に小さな泡が発生することに気づいた。そこで二人は,ボルタの電池の両端につないだ針金を水の中に浸してみた。すると,一方の針金から気泡が発生し,他方の針金は黒ずむではないか。この気体は水素,針金が黒ずむのは酸素が発生したためとわかり,彼らは電流によって水が酸素と水素に分解されたのだと結論を下した。
電池のこうした働きがわかるや,いろいろな化合物の電気分解が試みられた。なかでも特筆すべきは,デービー(1778−1829)によるカリウムの発見であろう。化合物中で元素を結合している力は電気的な力だと信じていたデービーは,強い電流さえ流せば,どんな化合物でも分解できるに違いないと考えた。1807年,化学薬品ではどうしても分解できなかったアルカリ性物質を,当時としては最大級の250個の電池を使って電気分解しようと試みた。飽和水溶液だとうまくいかないので,固体にわずかの湿り気を与えて直接に溶融と分解をやってみることにした。すると,陰極に金属光沢をもつ水銀とよく似た小さな丸い粒が現れるや,直ちに明るい光を放ち燃え出した。このときデービーは,嬉しさのあまり,実験室をとび回ったという。 |
|
|
電気分解の法則
|
|
|
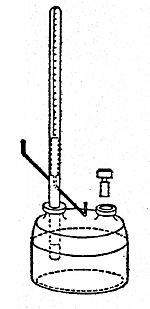
ファラデーは,まず,ボルタの電池からの電気や摩擦電気などが質的には同じであることを,電流の磁気作用や電気分解の作用を用いて証明してみせた。その過程で,磁針の振れが電気量の増加に伴って大きくなることにヒントを得て,電気分解される物質の量が電気量に比例することを実験的に明らかにした。そして彼は,この関係を使い,同一の電気量で分解される物質の量を比較しようと考えた。だが,肝心の電気量を測定する装置がない。実験には天才肌のファラデーは,さっそく,白金を封じ込んだ長い管内に希硫酸を満たすように設計された巧妙な装置を考案した(下図)。この装置を回路に入れると,分解されて管内に捕収された気体の量が,回路を流れた電気量に対応するというわけだ。実験の結果,同一の電気量で析出される物質の量と水素の重量との比(彼はこの値を電気化学量と呼んだ)が,つねに化学当量に一致することがわかった(1834年)。
こうして電流のもつ働きを詳しく研究したファラデーは,従来の電気分解の説明に疑問をいだき,つぎのような説を展開した。電流によって物質の化学的親和力が変化を受けて分極し,電流の径路にそって分極した粒子の分解と再結合が進行していくと。すなわち,電気分解の原因を,極からの引力・斥力ではなくて,粒子の存在している場所での電流の働きに求めたのである。そしてファラデーは,分解物質のうち極へ向かうものを新たに“イオン”と名づけた。これは,ギリシア語の“ienai”(行く)にちなんだものだが,現在のイオンの概念とはいささか異なっている。他にも彼は,“電極”“電解質”“陽イオン”“陰イオン”など,現在の中学生にもおなじみの多くの用語を新たに定義した。 |
|
|
イオンの移動速度は異なる
|
|
| ファラデーの活躍していた19世紀の初め頃は,商業圏の拡大に伴って実用的な電信への要望が高まり,電気には大きな期待が寄せられていた。ところが,電気を使った電信を実用化するには,分極のため起電力がすぐに低下するボルタの電池に代わる,安定な電池が必要であった。1837年,ダニエルは,電解質溶液を隔壁で仕切った二液式の電池を発明し,産業界の要望に応えた。ちなみに,わが国に業務用の電信が始まったのは明治2年である。当時の電信代は,かな一文字につき銀一分で,これだけあれば米が4升あまり買えたという。ところでダニエルは,隔壁で区切られた電解質溶液の両極付近の濃度を測定し,電気分解が進むにつれてその濃度が変化することを見つけた。 この濃度変化をさらに精密に測定したヒットルフは,イオンの移動速度に違いがあることを指摘し,相対的な移動速度が全析出量に対する移動量の比(輸率)に相当すると主張した(1853年)。さらに,交流を用いて電解質溶液の電気伝導度を測定していたコールラウシュはイオンの移動速度そのものを求めようと,つぎのような考えを展開した。まず,電気抵抗の原因は,独立に移動するイオンの受ける接触摩擦にあるとみなせば,うすい濃度の溶液では,その摩擦は水分からだけと考えてよい。そのため,各イオンはそれぞれ一定の抵抗を受けて運動するが,ファラデーの法則によると,そのイオンは種類に無関係な一定の電気を運ぶと思われる。したがって,電気伝導度は両イオンの速度の和に比例するはずだ。コールラウシュは,このような考えに基づき,自分の測定した電気伝導度とヒットルフの得た輸率を組み合わせて,個々のイオンの速度を知ることができた。電気分解の主役であるイオンが独立して運動すると考えていた点で,コールラウシュはほぼ今日のようなイオンの概念に達していたものの,電場のない溶液中でもイオンが存在しているとは思ってもみなかったようである。 |
|
|
電離説の登場
|
|
| コールラウシュの理論を進め,電解質溶液の理論を今日のような形に仕上げたのが,アーレニウス(1859−1927)である。稀薄溶液の電気伝導度を測定していたアーレニウスは,1883年,溶質分子は外部から電圧を加えなくても,電気を運ぶ“活性分子”とそうでない“非活性分子”に分かれているという新説を唱えた。そして,この“活性分子”数の全分子数に対する比を“活性係数”(今日の電離度)と定義し,この値が無限大稀釈においては1になると主張した。だが,こうした考えに基づく学位論文が最低の評価でパスしたことからもわかるように,当時の反応は冷たかった。「安定な化合物の食塩が水にとけるとすぐに分解するのはおかしいし,遊離したとしても,塩素特有の色や臭いを発しないのはどうしてか」といった疑問をいだく科学者が少なくなかったからだ。確かに,電気伝導の側面からだけでは,電圧が加わって初めて化合物が電離するのだという考えを完全に否定することは困難であった。 自説を裏づける確かな証拠を求めていたアーレニウスは,1886年,浸透圧に関するファント・ホッフの研究を知り,これこそ電離説の正しさを証明していると看破した。ファント・ホッフによると,多くの無機物では PV = i RT( i >1)の関係が成立し, i という異常係数が入ってくるという。この i こそ,水に溶けた電解質分子が電離して溶質分子の数を増やしていると考えればうまく説明がつくのではないか,とアーレニウスは考えた。さっそくこの i を,自分の電離説における解離度と,それとは全く別に凝固点降下の法則を使って算出したところ,両者の値がぴったりと一致した,“活性分子”は,とりもなおさずイオンであり,確かにそのイオンは溶液中に初めから存在していたのである。
この電離説は溶液理論に一大革命を引き起こすとともに,以後この理論に依拠してオストワルドの稀釈律やデバイの強電解質溶液理論など多くの理論が生み出されていったのである。 |