| 科学の歩みところどころ |
|
| 第15回 近代原子論の形成 |
|
| 森 一夫 児島昌雄 |
|
| 原子・分子概念は,今では科学を学ぶ者にとって欠くことのできない重要な概念である。ところが,この原子・分子概念が多くの化学者に認められるようになったのは,今からわずか100年余り前のことにすぎない。今回はこの近代的な原子論がどのようにして形成されたかを,18世紀以降の化学界に焦点をあてて,たどってゆくとしよう。 |
|
|
18世紀の化学界
|
|
| 18世紀の化学界といえば,前世紀にニュートンらが唱えた原子論的自然界で物質の性質を究明しようとする思潮が強かった。18世紀も終わりに近づくと,ラボアジェ(1743−94)が分析によって得られる最終物質こそ元素であるという近代元素観を確立して,根強く残っていた古代の元素観を一掃した。それによって,近代化学の誕生を告げることとなった。 18世紀末から19世紀初頭にかけて化学界では“定比例の法則”が論議を呼んだ。ラボアジェらも暗黙のうちに認めていたこの法則を,プルーストが正式に宣言するや,たちまちベルトレーは溶液・合金・ガラスなどを例にあげて反論を開始した。8年間も続いたこの論争はプルーストの勝利に終わったが,原子論と関係深いこの法則が話題になったことはやがて登場するドルトンの原子論に注目を集める下地をつくった。 |
|
|
近代原子論の創始者−ドルトン
|
|
やがてドルトンは,この原子論が化学結合にも適用できるのではないかと考えるようになった。そして1804年に,“沼気”(メタン)と“生油気”(エチレン)を分析して,一定量の炭素と化合している水素の割合が,“沼気”では“生油気”の2倍であることを見つけた。彼は,この“倍数比例の法則”の発見によって,化学現象に原子論が有効であることを示した。よく,ドルトンは定比例や倍数比例の法則から原子論を帰納したといわれるが,むしろ原子論という自然観で演繹的に倍数比例の法則を得たというべきであろう。 こうして原子論の有効性に自信をもったドルトンは,化学的分解・合成が諸原子の分離・結合にほかならないことを明言した。さらに,原子論を実験的事実と結びつけるためには,原子の相対的重量(原子量)や,いくつの原子が集まって1つの最小粒子(化合物)を構成しているか,を明らかにしなければならないと主張した。ところがいざ原子量を求めようとすると,やっかいな問題が立ちはだかっていた。原子量は,化合物の化学式と重量組成がわかってはじめて算出できるのに,実験からは重量組成しか得られないからだ。この難問をドルトンは,どう解決しようとしたのだろうか。今から考えると乱暴な話だが,2つの元素A,Bからなっている化合物で,1つの化合物しか知られていないときの化学式はABだというのである。たとえば,当時では水素と酸素の化合物として水しか知られていなかったので,水の化学式は今の元素記号で表せばHOということになる。では,2つの化合物がわかっているときはどうかといえば,その化学式の1つはAB,もう1つはA2BもしくはAB2だというわけである。 ドルトンがこの原子論を『化学の新体系』(1808)で発表したところ,たちまち化学界には一大センセーションがまき起こった。 世界的な大化学者となってからも,ドルトンは家庭教師で生計をたてながら,つましい市井の一庶民として生涯を過ごした。彼には次のようなエピソードが残っている。フランスのある学者がドルトンの家を訪問すると,鼻たれ小僧に算数を教えている人がいた。いぶかしげに,「ドルトン先生ですか」と尋ねると,ドルトンは,「はい,そうです。この子の算数を直すまでしばらく待っていてください」と答えたそうである。いかにもドルトンの人柄がしのばれる話ではないか。 |
|
|
ゲー・リュサックの法則
|
|
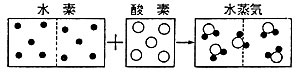
| ドルトンの原子論は,発表当時はまだ仮説的色彩が強かった。なかでも最大の弱点は,原子量を決める方法が見つからなかったことだ。ドルトンの方法では,いかにも観念的すぎる。この解決の鍵をにぎる法則が,1809年にゲー・リュサック(1778−1850)の手で発見された。それは,同温同圧のもとでは,反応する気体および生成した気体の容積が互いに簡単な整数比をなすという,気体反応の法則である。ちなみにゲー・リュサックは,1804年,気球に乗って当時としては最高の7000mの高さにまで上昇し,高層での温度や湿度を測定した英雄でもあった。 原子論に賛成する化学者は,この法則こそドルトンの原子論を支持する実験的事実だとみていた。ところが肝心のドルトンは,死ぬまでこの法則に反対しつづけた。なぜなら,この法則を彼の原子論で説明しようとすれば一定体積中に含まれる粒子数は同じか,もしくは簡単な整数比となるはずだが,そんなことは絶対にないとドルトンは信じていたからである。というのは,たとえば水蒸気と酸素の比重を測定して比べてみると,酸素のほうが大きい。ところが水の化学式はHOだから,同体積に同数の原子を含むとすれば,水蒸気は酸素よりも水素原子分だけ比重が大きくなるはずで,事実と合わない。したがって,同体積中には酸素原子のほうが水の粒子よりも多く含まれていなければならないというわけである。水素や酸素などの単体の気体粒子は1個の原子だと信じていたドルトンにすれば,こう考えたとしても無理はない。
だが原子論は,当時の化学者がすんなり受け入れたわけではなかった。定比例や倍数比例などの実験事実は認めるが,原子論は仮説でしかないというデービーの態度が,当時の大部分の化学者を代表していた。 |
|
|
同体積には同数の分子しかない
|
|
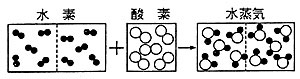
アボガドロの仮説によると,数多くの気体反応の実験的事実を説明できるだけでなく,原子量を算出する場合の手がかりも得られる。すなわち,気体の比重を測定すれば、それはとりもなおさず気体分子の比重でもあるから,たちどころに分子量が求められる。しかも,単体の気体分子は同種の2個の原子からなっているので,その原子量は容易に得られるのである。このように,アボガドロの仮説はすばらしい考えであったが,その重要性が正しく認識されたのは,なんとアボガドロの発表から半世紀も経た1860年のことであった。 |