
授業実践記録(化学)
溶けやすい水,溶けにくい水
~共通イオン効果から溶解度積の導入まで~
1.はじめに
「化学」の理論分野の中で,生徒が取っつきにくい分野の一つが「電離平衡」である。特に,共通イオン効果から溶解度積に至るところを難解に感じる生徒が多く,その導入には毎回腐心している。
ここでは,簡単な実験を通して,溶解度の復習から入り溶解度積の必要性に気づかせる導入例を紹介する。
2.準備
[生徒用10班分]
- ・純水500mL(500mLペットボトル入り)
- ・飽和塩化ナトリウム水溶液500mL(500mLペットボトル入り)
- ・塩化ナトリウム5g×10包
※「飽和塩化ナトリウム水溶液」「塩化ナトリウム」は以下の「授業の展開」では「飽和食塩水」「食塩」と表記。 - ・ビーカー(100mL)
- ・ガラス棒
[教師演示用]
- ・飽和塩化ナトリウム水溶液15mL
- ・濃塩酸10mL
- ・醤油15mL
- ・演示用試験管(18mmφ)2本
- ・駒込ピペット(2mL)1本
3.授業の展開
①ペットボトルから水を50mLほどビーカーに取るように指示する。1つのペットボトルには水,もう1つには飽和食塩水が入っているが,この段階では生徒にはどちらも「水」だと伝え,どちらでも好きな方を使うように指示する。
②薬包紙に包んだ食塩5gを各班に配り,①の水に溶かすように指示する。生徒は食塩をビーカーの中に入れて溶かし始める。水を選んだ班ではすぐに溶ける(図1)が,飽和食塩水(本人たちは水だと信じている)を選んだ班では,全く溶けない(図2)。中には意地になってガラス棒で懸命にかき混ぜる生徒もでてくる。
③生徒への発問と,生徒とのやりとり
先生 「なぜ溶けない班があるのかな?」
生徒A 「溶けない班はかき混ぜが足りない」「温度が違う?」など。
(なかなか正解は出ないときは,溶解度の話などヒントを出す。)
生徒B 「こっちの水には,始めから食塩が溶けていたのでは!?」
(気づいた生徒を指名して前で説明させる。)
生徒C 「先生ずるーい!」
生徒D 「それじゃあ,溶けっこないじゃん。」
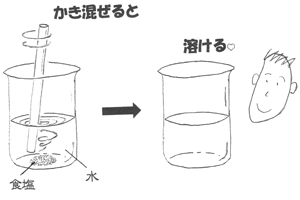
図 1
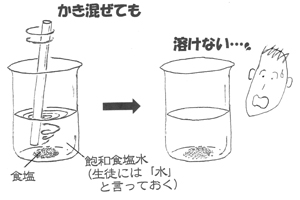
図 2
④水に溶ける物質でも「溶解度」という溶解の限界があることを思い出させる。溶質によって溶解度が違うことや,塩化ナトリウムの溶解度はどのくらいかを,教科書の該当ページを開いて復習させるとよい。
⑤飽和食塩水中で,次の溶解平衡が成立していることを板書して説明。
![]()
飽和食塩水では,これ以上溶解できないので,温度一定ならば,(1)の平衡を右に移動させることはできないことを説明。
⑥生徒への発問と,生徒とのやりとり
先生 「では,(1)の平衡を左に移動するにはどうすればいいか?」
(平衡移動の原理は既習である)。
生徒A 「Na+とCl-を加えればいい。」
生徒B 「でも,固体のNaClを入れたのでは,意味ないし…。」
生徒C 「イオンを足すなら,飽和水溶液を足せばいい。」
先生 「それはNa+とCl-を加えたことになるけど,飽和水溶液の体積が増えるだけで平衡は移動しないはず。」
生徒D 「Na+とCl-のどちらか一方だけでも平衡は左に移動するはず。だから,どちらかのイオンだけを足せばいい。」
(どちらか一方のイオンだけを加えるという意見が出ない場合は,それまでの平衡移動の復習をするなどヒントを出す。)
⑦「では,Cl-を加えることを考えよう。でも,陰イオンだけ加えることはできないので,Cl-の相棒の陽イオンを何にするかだね。」と言って,演示用の試験管(18mmφ)に飽和食塩水を15mLほど取る。
「では,ここに濃塩酸を加えてみましょう。食塩水と共通なイオンは?」と問いかけながら,駒込ピペットで,試験管の飽和食塩水に濃塩酸を加えていくと,塩化ナトリウムの白い沈殿が生じる(図3)。

図 3
⑧共通イオン効果の説明を板書する。
続けて,飽和でなくても高濃度の食塩が含まれていると同様の共通イオン効果が観察されることを説明。例として,試験管(18mmφ)に醤油を15mLほど取り,駒込ピペットで濃塩酸を加える(飽和食塩水よりも多めに加える)。醤油が濁りはじめ,やがて沈殿が観察される(図4)。

図 4
⑨ここで,溶解度から溶解度積につなげるために,次の説明をする。
「今までは,溶解の限界として溶解度を考えてきた。」
「溶解度では,個々のイオンの量ではなく溶質全体の量として考えているので,つねに[Na+]=[Cl-]であった。」
「さきほどの実験のように,[Na+]≠[Cl-]のときでも溶解の限界を超えて沈殿することがある。そのときの限界は[Na+]×[Cl-]の量で定義する必要がある。」
⑩特に難溶性塩の溶解の限界として,塩化銀の例を取り上げ,
溶解度積[Ag+]×[Cl-]=Kspを定義する。
4.生徒の反応
・「飽和水溶液」の概念を頭では理解している生徒も,実際に「食塩が,それ以上溶けない」ことを体験すると驚く。
・醤油に濃塩酸を滴下する実験には,ほとんどの生徒が興味を示し,「塩分ひかえめ醤油」や「薄口醤油」と比較してみたいと言い出す生徒も出てくる。時間があれば種々の醤油でも試してみるとよい。
【参考データ】(醤油15mL中の食塩相当量)
| ・しぼりたて 生しょうゆ(キッコーマン) ……………… | 2.4g |
| ・塩分ひかえめ 丸大豆 生しょうゆ(キッコーマン)… | 1.9g |
| ・しぼりたて うすくち 生しょうゆ(キッコーマン) …… | 2.3g |
5.考察
・本校では,「無機物質」を先に学習しているので,塩類の水への溶解性を○か×か(可溶か不溶か)と考えている生徒もいる。そのため,難溶性の塩の溶解度積が登場すると,戸惑いを感じる生徒も多い。そこで,本実験を導入とすれば,「水に可溶」と思っている塩も,限度(溶解度)を超えれば,それ以上溶けずに溶解平衡が成り立っていることを実感させ,「可溶」も「不溶」も程度の問題であることを理解させることができる。
・飽和食塩水に濃塩酸を滴下して塩化ナトリウムを沈殿させる実験を発展させて,「塩化ナトリウムを溶かす場合,水と塩酸のどちらに,より多く溶かすことができるか」を考えさせることもできる。さらに,塩化ナトリウムを塩化銀に置き換えれば,溶解度積の問題演習にもつなげられる。
・溶解度はNaClが水に何g溶けるかを考えていたので,つねに[Na+]=[Cl-]を当然と受け止めている生徒が多い。ところが,溶解度積の学習では[Ag+]≠[Cl-]の場合も出てくるので,戸惑うことになる。本実験では,先に[Na+]≠[Cl-]を体験させておくことができる。また,溶解度から溶解度積を求める問題や,逆に溶解度積から溶解度を求める問題では,スムーズに[Ag+]=[Cl-]と考えることができるようになる。
6.おまけの実験
「水と飽和食塩水は見た目にはどちらも無色透明。では,簡単に見分ける方法はあるか?ただし、味を見てはいけない。」と問いかけてみる。「食塩が溶けるかどうか調べる。」「硝酸銀水溶液を加える。」等の答が出てくるので,「ペットボトルの蓋を開けずに見分けられないかな?」と言ってから,以下の実験をする。
①本実験で残った,水と飽和食塩水が入っている2つのペットボトルを,両方の手で持ち,上下に激しく振って,左右の耳元にもっていく。水は気泡がすぐに消えるが,飽和食塩水は気泡がなかなか消えないため,「シュワ,シュワ……」という音が耳元で暫く続く(図5)。
②生徒とのやりとり
先生 「あっ,聞き分けられた! 飽和食塩水の方は『僕は飽和,飽和,飽和…』ってブツブツ言っている!」
生徒A 「そんなわけないじゃん」
先生 (もう一回やってみせて)「やっぱり,飽和食塩水のつぶやきが聞こえるよ。やってみたい人は?」
生徒B 「やりたい!」(前に出てきてやってもらうと,とても驚き,)「本当に聞こえる!」
(その生徒の表情を見て,多くの生徒が自分でもやってみたくなる。何人かにやらせると教室中が盛り上がる。)
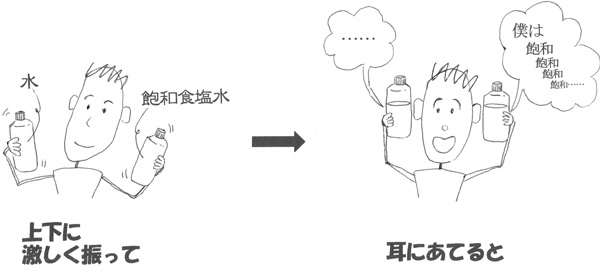
図 5


