
授業実践記録(化学)
酸化還元反応の身の回りへの応用
~「亜鉛めっき」をとおして~
1.はじめに
酸化還元反応は化学を学習する上で重要な化学反応の1つである。小学校6年生の『ものが燃えるとき』の単元では,はじめて酸化反応に触れ,『水溶液の性質』の単元では,塩酸とアルミニウムから気体(水素)が発生することを学習している。中学校になると,1年次には化学反応式を用いて酸化還元反応を表現し,3年次には電気分解や電池のしくみについて学習する。一方,高等学校では酸化還元反応の定義を酸素の授受だけでなく,水素や電子の授受という観点にまで拡張して学習する1)。このように酸化還元反応は小学校時代から継続して学習している重要な化学反応である。
ところで高等学校では,酸化還元の応用で「めっき」について学習を行う。ここでは「めっき」の特徴(利点等)や用途について学習する。教科書によっては,「めっき」の作成について,工業的な製法以外に実験室的な製法が記載されているものもある(主に無電解めっき)。しかしながら,その原理についてまで詳しく記述されている教科書はない。その理由として過電圧や標準電極電位等の大学レベルの知識が必要とされるためである。そのため,「めっき」を原理まで取り入れている授業実践報告は少ない。そこで本稿では,定性的に「めっき」の原理を学習できる授業実践を試みたので報告する。実験の原理などを説明する際にはプレゼンテーションソフトを活用し,理解度の向上を図るために言語活動の時間を取り入れた。題材としては実験操作が簡単で安全(水酸化ナトリウムを用いない方法)かつ安価に行える「亜鉛めっき」を用いた。
2.実験の概略
2.1 実験装置,器具2)
器具:蒸発皿(90mmφ程度),ガスバーナー,三脚,金網,ピンセット,キムワイプ,サンドペーパー
薬品:銅板,6mol/L塩化亜鉛水溶液10mL,亜鉛粉末
2.2 実験操作
①亜鉛粉末5gを蒸発皿に入れる。亜鉛は粒状でもよいが反応は遅くなるので留意する。
②亜鉛を覆うのに十分な量(10mLぐらい)の6mol/L塩化亜鉛水溶液を加え,蒸発皿の1/3ぐらいのところまで満たし,水溶液が50~80℃ぐらいになるよう加熱する。
③亜鉛粉末が固まってきたら,サンドペーパーで磨いた銅板をピンセットで挟んで塩化亜鉛水溶液の中に入れる。
④1~2分で銅板が銀色になり「亜鉛めっき」される。全体が十分に銀色になったら銅板を注意深く取り出し,水洗する。洗浄した銅板はペーパータオルで水分をふき取る。
⑤銀色になった銅板をピンセットで挟んで,弱火にしたガスバーナーの炎の中に入れる。
⑥3~5秒後,銅板が金色になったらすぐに炎から取り出し水洗し,乾燥する。
※留意事項:亜鉛粉末は,発火の危険性があるため紙などの可燃物と一緒に捨てないようにする。
金属容器に入れ,完全に酸化してから処理を行う事。
 |
 |
| 写真1 「亜鉛めっき」用の実験器具(左) | 写真2 作成した「亜鉛めっき」 (左:銅,中:「亜鉛めっき」加熱前,右:加熱後) |
2.3 合金の生成
「亜鉛めっき」を行った銅板を加熱すると,金色の黄銅(真鍮)が生成する。黄銅は置換型合金である。これは銅と亜鉛の原子半径が似ているために起こる現象である(銅の原子半径0.128nm,亜鉛の原子半径0.137nm)。「亜鉛めっき」した銅板をグリセリン中で加熱しながら温度を測定していくと,めっき層の薄い部分は約100℃前後で金色に変化し,合金になることが報告されている3)。
2.4 「亜鉛めっき」の原理
亜鉛が銅板上に析出する機構は,カルバニ電池に類似した酸化還元反応で説明できる。酸化還元反応は標準電極電位E0を用いて考えると理解しやすい(表1)。
 |
| 表1 標準電極電位4) |
E0は標準水素電極([H+]=1mol/Lの塩酸に溶液中に,多孔質の白金電極を浸し,その表面に25℃,1×105Paの水素ガスを吹き付けたもの)を基準として決められており,多くの場合は熱力学の理論に従って求められる。
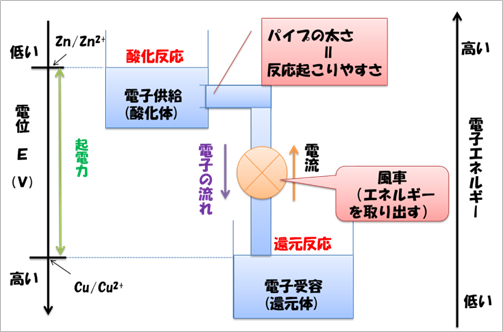 |
| 図1 電位と酸化還元反応の関係5) |
電位と酸化還元反応の関係を図1に示した。標準電極電位E0が負に大きい(電位が低い)酸化還元対ほど,還元体は酸化されやすく,酸化体は還元されやすい。逆にE0が正に大きい(電位が高い)酸化還元対ほど還元体は酸化されにくく,酸化体は還元されやすくなる。要するに,2種類の電子授受系が共存すると,E0の低い系の還元体が電子を出し,それをE0の高い系の酸化体が受け取ることで酸化還元反応は進む。
電池では2種類の電位の異なる導電体(主に金属)が出会ったとき,電位の低い物質は負極になり,電位の高い物質は正極になる。負極付近で最も電位の低い物質(負極も含める)が酸化され電子を放出する(負極活物質)。その電子が導線を通り正極付近に集まり,正極付近で最も電位の高い物質(正極活物質)が電子を受け取ることによって反応が進行する。電池ではこの酸化還元反応が自発的に起こっており,私たちはこの反応に伴って放出される化学エネルギーを電気エネルギーとして取り出している。
また,電池の起電力は各極の活物質のE0の差に相当する(正確に言えば電極電位Eの差である)。例えば,ダニエル電池の正極活物質はCu2+で負極活物質はZnであるのでE0の差は
+0.34-(-0.76)=1.1 V
となる。
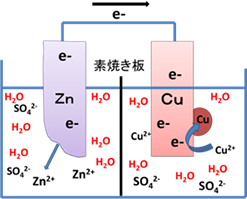
図2は高校で学習するZn-Cuカルバニ電池(ダニエル電池)である。
 |
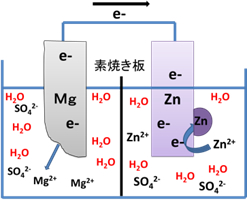 |
| 図2 ダニエル電池 | 図3 Mg-Znカルバニ電池 |
ダニエル電池の各極での半反応式と標準電極電位E0を示すと以下のようになる。
| 負極 | Zn → Zn2+ + 2e- …(1) |
| E0 = -0.76 V vs. SHE | |
| 正極 | Cu2+ + 2e- → Cu …(2) |
| E0 = +0.34 V vs. SHE |
Zn + Cu2+ → Zn2+ +Cu ⊿E=1.10 V
SHE:標準水素電極(1mol/L)
ダニエル電池では,両極のうち電位の低い亜鉛板が酸化され電位の高い銅板へ電子が移動する。その電子を水溶液中で最も電位の高い銅イオンが受け取ることで反応が進行する。
同様にMg-Znカルバニ電池の各極の反応式を示す。
| 負極 | Mg → Mg2+ + 2e- |
| E0 =-2.37 V vs. SHE …(3) | |
| 正極 | Zn2+ + 2e- → Zn |
| E0 =-0.76 V vs. SHE …(4) |
Mg + Zn2+ → Mg2+ +Zn ⊿E=1.61 V
この場合も両極のうち電位の低いマグネシウム板が亜鉛イオンになって溶け出し,その際に生じた電子が電位の高い亜鉛板へ移動する。亜鉛板付近の水溶液中には亜鉛イオンと水が存在するが,水よりも標準電極電位E0の高い亜鉛イオンが電子を受け取ることで反応が進行する(図3)。
なお,正極の反応を考える際に水素イオンの存在はほぼ無視して考えることができる。水素イオンのE0は亜鉛イオンよりも高く電子を受け取りやすいが,硫酸亜鉛水溶液はpH =4程度の中程度の酸性水溶液(亜鉛イオンの加水分解による)であるため,水素イオンのモル濃度が水(55.6mol/L)や亜鉛イオン(1mol/L)に比べて圧倒的に小さい。このため,仮に電子を受け取ったとしても水素の発生は無視できる程度である。
ところで,Mg-Znカルバニ電池では正極活物質になりうる水と亜鉛の電位差を比較すると0.07V程度であるので,水の還元による水素の発生も起こる可能性があるが,過電圧(活性化過電圧)が影響して水素の発生は起こりにくいと考えられる。
実際にMg-Znカルバニ電池を作成して亜鉛極側で起こる反応の検証を行った(MgSOE4aq,ZnSO4aqともに1mol/L,写真2)。その結果,亜鉛極側からは目視で確認できる水素発生は起こらなかった。また,起電力を測定したところ1.60V近くまで観測されたがすぐに起電力が0.70V程度に低下した。これは分極したためであると考えられる(マグネシウム極で水素が発生)。表面を良く磨いたマグネシウムは常温の水に入れても目視できるほどの水素を発生する。
 |
 |
| 写真2 左:Mg-Zn型カルバニ電池の材料 (左から発泡スチロール,セルロースチューブ,亜鉛板,マグネシウムリボン,プラスチックコップ,テスター) |
右:作成した電池 |
以上のことをふまえ,銅板の上に亜鉛が析出する反応(「亜鉛めっき」)について説明する。塩化亜鉛水溶液中の亜鉛粉末に銅板を接触させると,両金属のうち電位の低い亜鉛から電子の一部が電位の高い銅板に移動する(局部電池の完成)。水溶液中で銅板付近に存在する最も電位の高い亜鉛イオンが,銅板へ移動してきた電子によって還元され,金属亜鉛として銅板上に析出し,その結果として「亜鉛めっき」が生成する(図4)。
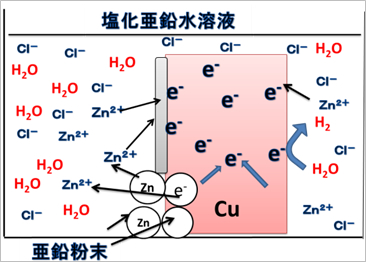 |
| 図4 「亜鉛めっき」の原理図 |
この場合でもMg-Znカルバニ電池と同様に水の還元による水素発生はかなり抑えられる。実験を行うと銅板上では初め僅かながら水素の発生が見られるが,亜鉛で覆われると水素発生が見られなくなる。これは亜鉛の水素過電圧(水の還元による)が銅よりも大きいことを示唆している。また,塩化亜鉛水溶液の濃度を6.0mol/Lという高い濃度にしているのは電極反応を促進するためである。表1に挙げたE0は電子授受の平衡反応式に関与する物質の活量(モル濃度)をすべて1としたときのものである。そのため,実際の活量を考慮した電極電位Eはネルンストの式を用いて以下のように表すことができる。
Zn2+ + 2e- → Zn
E = E0 + (0.059 / 2)log10[Zn2+]…(5)
E: 電極電位 E0:標準電極電位
6.0mol/Lの塩化亜鉛水溶液では,式(5)を用いて電位の計算を行うと,E=-0.76+0.023 Vになる。このためE0よりも正の電位に傾き,電子を受け取り易くなっている。
3.授業実践
3.1 授業概要
2回に分けて授業を行った。1時間目はプレゼンテーションソフト(パワーポイント)を用いての講義と生徒実験を行った。「亜鉛めっき」の導入として錬金術やオリンピックのメダルの製法を取り入れ,メダルの製法等と酸化還元反応との関係,標準電極電位とイオン化傾向の関係等の説明を行った。次に「亜鉛めっき」の原理と解説をダニエル電池と対応させて行った後,実験を開始させた。生徒は4人1組の班で作業し,各自が「亜鉛めっき」を作成した。最後に合金の作成も行った。
2時間目は「亜鉛めっき」の原理について更に理解を深めるため,班毎に話し合いをさせて各自でレポートにまとめる時間とした(生徒には前授業で使用したスライドのコピーを配布し,スライド,教科書,資料集を用いてレポート作成を行わせた)。使用した実験プリントには「亜鉛めっき」の原理を記述する欄以外に「めっき合金」の種類,用途等を記述する欄を設け,言語活動が終了した班から取り組むよう指示した。
3.2 場所・対象クラス
化学実験室(1時間目),5年1組教室(2時間目)
5年1組(高2理系 男子15名 女子22名 計37名)
 |
 |
| 写真3 実験授業風景 | |
3.3 実践の成果と課題
生徒の感想をいくつか以下に挙げる。
○実験をすることで「めっき」の仕組みがわかった。文系科目選択者の友だちに合金を見せたらリアクションがよくて楽しかった。
○こんな簡単に合金を作れるとは思っていなかったので驚いた。「めっき」や合金が色々なところに使われていることにも驚いた。
○思いのほか実験操作が簡単であった。他の「めっき」や合金もつくってみたい。
操作が簡単であったためすべての班が実験に成功した。また,赤色の銅板が,「亜鉛めっき」で銀色に,加熱によって金色(黄銅)に変化するところは,多くの生徒が驚き感嘆の声をあげていた。
標準電極電位や過電圧,「亜鉛めっき」の原理については,プレゼンテーションソフト(パワーポイント)を用いて説明しただけでは理解が浅いようであった。しかし,2時間目に各班での話し合いとディスカッションの時間を設けたことで理解が深まっていった。標準電極電位や過電圧に対してより理解を深めるには,反応速度や化学平衡の知識が必要不可欠である。今回,酸化還元反応の単元で「めっき」の学習を取り入れたが,反応速度や化学平衡を学習した後に無機化学(トタン,ブリキ)の単元で取り上げていけば,生徒の理解がより深まるのではないかと考えている。また,本時では「亜鉛めっき」の原理を先に説明したが,「亜鉛めっき」の原理を考えさせる授業も化学の理論分野の学習後なら可能ではないだろうか(教科書に解答が掲載されていない問題を考えさせることは生徒の知的好奇心を刺激するだろう)。
4.おわりに
1つの化学反応,化学現象を説明するためには数多くの知識が必要である。これをいかに高校生にわかりやすく噛み砕いて説明できるかが高校教員としての必要な力であることを再確認した。学習指導要領には『言語活動の充実』が謳われているが,今後は言語活動も積極的に授業に取り入れる展開を工夫するとともに,生徒の思考力・判断力・表現力の更なる向上を目指して実践に取り組んでいきたい。また,高校生が課題意識を持って主体的に考え,予想し,議論し,実験し,参加するような授業,すなわちアクテイブ・ラーニングがさらに大切になってくるであろうと思われる。
参考文献
1)斉藤烈 他,高等学校理科,啓林館,化学,化学基礎
2)高木春光,化学と教育,2013,61,10
3)高木春充 他,平成10年度研究発表収録,東京都理科教育会,1998,p.30-31
4)JOHN McMURRY,東京化学同人,一般化学(上)(下)
5)小久見善八,オーム社出版局,電気化学


