| 化学授業実践記録 |
|
| 授業展開の工夫 |
|
| 青森県立五所川原高等学校 木立 徹 |
|
|
はじめに
|
|
| 五所川原高校は、1学年5クラス(普通科4クラス、理数科1クラス)で定員200名の全校生徒647名(3学年6クラス)の学校である。ほとんどの生徒が大学進学を志望し、例年、百数十名の生徒が国公立大学へ合格しているのが特色の一つとなっている。 しかし、現在新課程の生徒が入学し、痛切に感じるのは旧課程の生徒との学力差である。学習習慣のない生徒が増えてきたようにも思えるし、実体験が少ない生徒も多くなってきたように感じる。 そこで今回、授業展開と演示実験の工夫と、生徒の質問で気になった熱化学方程式の展開について紹介したい。 |
|
|
1.予習度チェックの導入
|
|
| 学習には、「予習・授業・復習」という、黄金のサイクルがある。英語や数学、古典などは、予習してきなさいと指導すると、多くの生徒は予習してきているようである。しかし、予習してきなさいといっても、化学という科目を予習してくる生徒はほとんどいない。教科書だけでも読んでくるように指導しても、読んでこないものである。 そこで、とくに予習をやってもらうことを考え、今まで実施したことはなかった予習度チェックを始めた。  教科書を読んできているかを確認するためのもので、1時間の進度に応じた教科書の要約を、穴埋め問題にし、授業の始まりに5分間程度の小テストとして実施している。 教科書を読んできているかを確認するためのもので、1時間の進度に応じた教科書の要約を、穴埋め問題にし、授業の始まりに5分間程度の小テストとして実施している。授業を受けるときは、必ず予習をする習慣をつけるようにしなさいと指導を続けてきた。この予習度チェックの実施により、授業前に生徒は座席に着くようになり、教科書を読む光景が定着し始めた。 予習度チェック 小テスト |
|
|
2.黒板に貼る演示実験の工夫
|
|
| 現在の学校に勤務して7年目になるが、そのうち3年間は改修工事などで化学室を使うことができなかった(昨年は薬品庫も閉鎖した)。実験ができないのであれば、せめて演示実験だけでもやって、現象を見せてあげたいと考えた。 以前、東京都理科教育研究会化学専門委員会から、黒板化学実験の工夫が紹介された。二酸化炭素の発生や、中和滴定の演示、硫化水素による金属イオンの検出など、さまざまな実験が黒板に貼られて演示されるのである。この良い点は、黒板を使うことによって狭い教卓に実験装置を置かなくてもよいこと、高い位置に実験装置を置き、説明をそのまま黒板に書き込めることなどが挙げられる。 私自身も、試験管を用いてボルタ電池を黒板に貼り付けたり、曲管を用いて蒸気圧降下の演示も行った。 今回、実施をしたのは炎色反応を黒板に貼り付けたものである。 炎色反応の演示実験 試験管立てをマグネットシートを貼り付けた台の上に置き、試験管をアルコールランプにし、それぞれの金属イオンの炎色反応を確認するものである。 |
|
|
3.1、2についてのまとめと課題
|
|
| 予習度チェックを行うと、生徒が予備知識を持って授業に臨むようになり、授業の展開も行いやすい。今年度実施したばかりで、はっきりとした結果は出ていないが、生徒の理解度も良いように思える。 黒板に貼る演示実験は、生徒の視覚にうったえ、生徒の関心も高く、授業の展開も行いやすい。ものによっては、生徒自身に演示実験を行ってもらえるものもあり、化学への興味付けにつながるのではないかと感じている。 予習・授業・復習となると、残るのは復習ということになるが、残念ながらまだ確認テストを継続的に実施したことはない。これからの課題として、積み重ねていきたいと考えている。 また、観点別の評価について考えると、この予習度チェックは興味・関心・態度の評価として利用できるのではないかと考えている。これに確認テストを加えれば、知識・理解の評価として利用できるとも考えている。 |
|
|
4.燃焼熱から生成熱を求める工夫
|
|
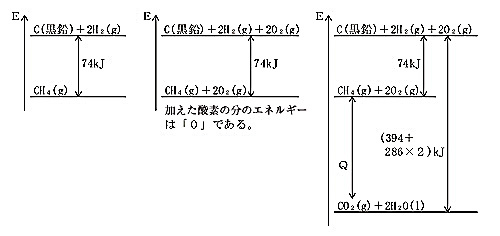
| ヘスの法則を応用して、目的のエネルギーを求める方法の中で、本校の生徒がよく質問する問題について、挙げてみたい。 問 二酸化炭素(気体)、水(液体)、メタン(気体)の生成熱をそれぞれ394kJ/mol、286kJ/mol、74kJ/molとするとき、メタンの燃焼熱を求めよ。 CH4(g)+2O2(g)=CO2(g)+2H2O(l)+QkJ と表せる。 Q=(394+286×2)−(74+0×2)=892〔kJ〕 となる。 このように解答すると生徒は、酸素の生成熱はどうして「0」なのか、疑問に思うようである。単体には生成熱はないからだと、説明しても納得しないようである。 C(黒鉛)+2H2(g)=CH4(g)+74kJ この式の両辺に、2O2(g)を加える。 C(黒鉛)+2H2(g)+2O2(g)=CH4(g)+2O2(g)+74kJ ここで「両辺に2O2(g)を加えたのであり、2O2(g)のエネルギーは『0』だと考えよう」と、説明しておく。 CH4(g)+2O2(g)+74kJ=C(黒鉛)+2H2(g)+2O2(g)……[1] 二酸化炭素、水の生成熱を表す熱化学方程式は、次式で表される。 C(黒鉛)+O2=CO2(g)+394kJ……[2] [2]+2×[3] より C(黒鉛)+2H2(g)+2O2(g)=CO2(g)+2H2O(l)+394kJ+286kJ×2……[4] [1]+[4] を行い、式を整理すると
CH4(g)+2O2(g)=CO2(g)+2H2O(l)+394kJ+286kJ×2−74kJ この下線の部分が、Q=(394+286×2)−(74+0×2) の部分だと言うと、なんとなくわかったような、ごまかされたような気分になるようだ。生成熱を連立した解き方と同じことで、何の工夫もないわけだが、数学でも公式を一度説明してから、この公式を使えるようになりなさいと言うので、化学でも公式は一度説明しなければならないと感じている。
|